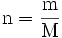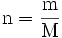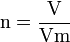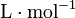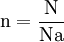La mole
La mole (symbole : mol) est une unité de base du
système international, apparue en 1971, qui est principalement utilisée en
physique et en chimie. La mole est la quantité de matière d'un système
contenant autant d'entités élémentaires qu'il y a d'atomes dans 0,012 kilogramme
de carbone 12 ; son symbole est mol.
Une mole d’atomes contient environ 6,022×1023 atomes (une
approximation plus correcte serait 6,02214179(30)×1023). Ce nombre
est appelé constante d'Avogadro, son symbole est
NA.
Un échantillon de matière normal contient un très
grand nombre d'atomes. Par exemple, six grammes d'aluminium contiennent
environ 1,34 × 1023 atomes
Pour éviter l'utilisation d'aussi grands nombres, on a créé une unité de mesure,
la mole.
Quand il est question de mole, il est essentiel d'aussi indiquer la nature
des entités élémentaires. Celles-ci peuvent être :
- des atomes
- des molécules
- des ions
- des électrons
- d'autres particules
- des groupes de particules
Pour donner un ordre de grandeur, une mole de secondes représente 4 milliard
de fois l'estimation de l'âge de la terre.
Toujours pour un ordre de grandeur, une mole de grains de sable de 0.1 mm (
sable très fin ) est contenue dans un cube de 10km³.
Formules
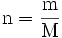
- n : quantité de matière en mol
- m : masse du composé en g
- M :masse molaire du
composé en

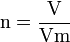
- n : quantité de matière en mol
- V : volume du gaz en L
- Vm : volume molaire du composé en
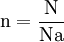
- n : quantité de matière en mol
- N : nombre d'entités chimiques (sans unité).
- Na : nombre d'Avogadro (mol − 1)